멸균 공정에 대한 전반적인 validation 접근 방법 및 예시에 대하여 이어서 이야기 할 것이다.
[Sterilization Cycle Development]
이번에는 멸균 사이클 개발 (Sterilization Cycle Development)에 대하여 이야기 해 보도록 하겠다.
멸균 Cycle을 개발 및 적용하는 일반적인 Flow는 아래와 같다.
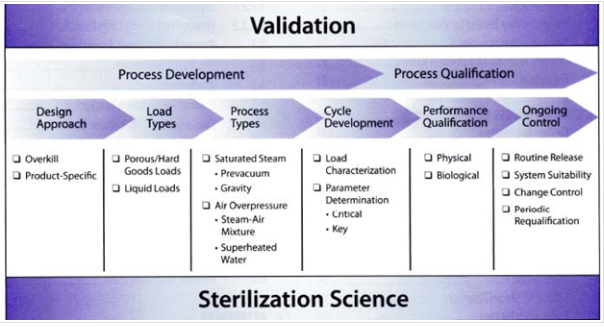
멸균 Cycle의 개발에는 크게 아래와 같이 두가지 접근 방법이 있다.
Overkill Sterilization – 최대 1,000,000eu의 미생물을 1eu이하의 생존확률로 F0=12 이상의 값을 요구하는 멸균
Bioburden Sterilization – 제품에 부하되는 미생물의 D-value를 결정한 후 가장 강한 미생물을 BI로 사용하여 1,000,000 EU의 미생물을 1eu 이하의 생존확률로 멸균
위의 두 가지 방법을 비교하면 아래와 같으며, 일반적으로 Overkill approach를 더욱 선호 한다.

위와 같이 두 가지의 접근 방법이 있지만, 결국 Validation에서 기대하는 것은 단 한가지. SAL 이다.

멸균 Cycle 개발은 (1) 축적된 F0에 대한 검증 기대치를 충족시키기 위해 적절한 온도 set point 및 노출 시간을 결정하기 위해 센서(열전대 등)를 사용한 여러 연구를 수행해야 하고, (2) Bioburden cycle의 경우 제품에서 가장 내열성 유기체를 분리하고 D value를 결정하고 필요한 F 값을 계산해야 하며, (3) Cycle이 제품의 멸균을 위한 것일 경우 (즉, terminal sterilization) cycle이 제품의 안정성에 미치는 영향을 결정해야 한다.
이 글에서는 멸균 사이클의 개발에 관련하여 이야기 해 보았다.
다음 글에서는 멸균 사이클의 밸리데이션에 대하여 이야기 해 보도록 하겠다.