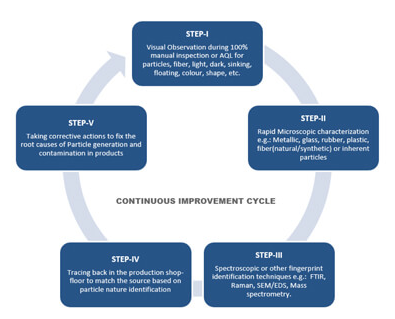
STERILITY 1862년에 파스퇴르가 질병이 발생하는 원인이 세균일 수 있음을 제안한 후 인간에게 영향을 미치거나 특정한 현상을 일으키는 미생물이 특정 시스템 내에 존재하는지 여부를 검출 할 수 있는 조건을 확립하기 위하여 다양한 방법이 시도 되었으며, 이러한 지식을 응용하여 원치 않는 미생물을 제거하는 방법을 고안하여 적용 할 수 있게 되었다. * The dictionary definition: 기구, 음식물 등에 ‘균이 없는‘, ‘멸균 상태인‘ 뜻으로 사용 됨. * Definition in the pharmaceutical industry: 정량적인 뜻은 차후에 자신을 복제할 수 있는 능력이 있는 미생물이나, 포자(Spore)가 없는 상태를 의미. 그러나 이는 이론적인 정의이고 실제 산업에서 말하..