"essentially free", "practically free” 및 "free from readily detectable" 이물과 같은 약전 표현의 차이와 상관없이 전 세계적으로 무균의약품(주사제)에는 눈에 보이는 이물(particulates)이 없어야 한다는 기대가 커지고 있다. 우리는 그 이유를 잘 알고 있다. 무균의약품(주사제)의 이물은 환자의 안전에 영향을 미치는 중요한 품질 속성을 나타낸다. 이물(particulates) 물질의 임상적 의미는 위험 평가를 복잡하게 만드는 다양한 요인(크기, 수, 구성, 미세 오염 가능성, 투여 경로, 의도된 환자 모집단 및 환자의 임상 상태)에 따라 다르다. 그리고 데이터에 따르면 2015년에서 2020년 사이에 무균의약품(주사제)이 리콜되는 가장 큰 이유는 이물(particulates)이다.
아이러니하게도 우리의 현재 생산 시스템은 100% 정확도로 이물(particulates)을 Detection 할 수 있는 무균의약품(주사제)을 생산할 수 없다. 용기 특성, 검사 조건, 제형 특성 및 이물(particulates) 특성과 같은 여러 요인에 따라 달라지는 검출 확률(POD, Probability of Detection)은 여전히 업계에서 우리의 한계를 옹호하는 강력한 논쟁거리로 남아 있다.
예방이 검출보다 낫다! (Prevention is better than Detection)
이물(particulates)은 Package, 멸균백, 장갑, 실리콘 튜브 및 Gasket과 같이 사용되는 소모품, 바이알 및 고무전과 같은 1차 자재, 심지어는 장비와 같이 무균 처리 시설 내부와 주변에 있는 거의 모든 것으로부터 발생할 수 있다. 이물(particulates)에 원인이 무엇인지 이해하는 것은 이물(particulates)에 대응하는데 매우 중요하다. 최신 도구와 기술을 사용하더라도 완제품의 이물(particulates) defect를 정확하게 감지하고 완전히 제거할 수 없기 때문에 원인에서 이물(particulates)을 제어하는 것 외에 다른 옵션이 없다.
지속적인 개선 프로그램 적용 (Adopting a CI Program)
효율적인 지속적인 개선(CI, Continuous Improvement) 프로그램을 적용하는 것은 ZERO-DEFECT 목표를 향해 나아가는 열쇠이다(그림 1 참조). 여기에는 이물(particulates)를 식별하는 지속적인 프로세스를 만들고 처리 영역, 장비 및 원자재에서 이물(particulates)를 추적하고 제품을 오염시키는 것을 방지하기 위한 제어 전략을 수립하는 것이 포함된다. 첫 번째 단계는 가시적 특성(예: 섬유 입자, 색상, 부유 등)을 기반으로 관찰 가능한 이물(particulates) Defect의 일차 식별 및 분리하는 우수한 육안 검사 프로그램을 설정하는 것이다.
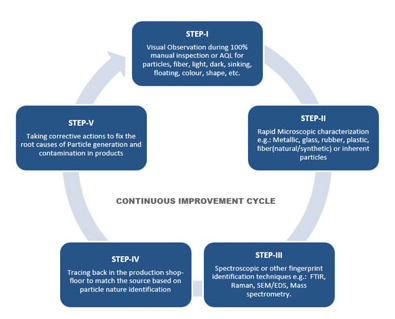
2차 식별은 시각적으로 분리된 Defect를 현미경으로 관찰하여 수행되며, 이는 금속, 유리, 고무, 섬유 및 용해되지 않은 원료와 같은 이물(particulates)의 총 구성을 추정하는 데 도움이 된다. 이는 또한 이물검사자가 식별한 Defect 범주를 확인하고 나중에 교육 및 검증을 위해 Defect library를 만드는 데 도움이 된다. 일반적으로 숙련된 이물검사자는 작업장에서 범주별로 이물(particulates)를 분리하고 진행 중인 생산 배치를 추적할 수 있다.
다음으로 FT-IR, Raman 또는 SEM/EDS와 같은 기술을 사용하는 분광 또는 기타 기술을 사용하여 이러한 대표적인 이물(particulates) Sample에 대한 분석을 수행할 수 있다. 이 궁극적인 식별 수준은 이물(particulates)의 특성에 대한 의미 있는 정보를 제공한다. 이 식별 수준에서 얻은 결과는 생산 영역의 이물(particulates)와 유입되는 물질의 출처를 추청하는 데 도움이 된다.
이물(particulates)의 특성을 식별했으면 다음 단계는 원인을 식별하는 것 이다. 이를 위해서는 무균 구역 부근에 있는 모든 것을 확인하고 이물(particulates) sample을 수집하고 유사한 특성화 테스트를 실행해야 한다.
전체 프로그램은 샘플링, 테스트, 조사, 시정 및 예방 조치 및 후속 조치의 전체 프로세스를 제어하는 프로토콜을 사용하여 작업 현장을 감시 할 수 있는 팀에서 가장 잘 관리할 수 있다. 이러한 활동을 수행하는 일반적인 빈도는 잠재적인 이물(particulates) 원인에 대한 지속적인 제어를 유지하고 프로세스를 개선하는 데 도움이 된다. 검사 또는 후속 식별 프로세스 중에 비정형 이물(particulates) 또는 비정상적인 Defect trend이 관찰되는 경우 특별한 주의를 기울여야 한다.
적격성 기준의 적용 (Implementing Qualification Criteria)
무균 구역에 들어가는 각 원자재, 구성 요소 및 장비 부품의 이물(particulates) 발생 특성과 관련하여 우수한 테스트 및 적격성 기준을 적용하는 것이 제품의 이물(particulates) 제어를 잘하는 열쇠이다. 이는 상호 동의할 수 있는 기준을 설정하여 모든 원자재의 품질을 구축하고 유지하기 위해 공급업체와의 지속적인 협력 및 벤치마킹을 수반한다. 목적에 적합한 원자재 또는 구성요소를 선택하고 각각에 사용 기한을 지정하는 것은 이 제어 전략의 중요한 부분이다. 원자재, 구성 요소, 장비 또는 부품의 변경은 아무리 사소해 보일지라도 부적절한 결과를 나태내지 않기 위해 적격한 기준을 충족해야 한다.
무균의약품(주사제)의 이물(particulates) 생성 및 오염을 초래하는 Fail mode에 대한 철저한 이해는 Zero-particulates 목표를 향한 절반의 전투에서 승리하는 것과 같다. 지속적인 개선 프로그램을 설정하고 모든 원자재, 구성 요소 및 장비 부품의 적격성 및 표준화를 통해 변동성을 제어하면 이 도전적인 목표에 한 걸음 더 다가갈 수 있다. 아울러, 무균의약품 제조업체, 공급업체 및 규제 기관 간의 지속적인 협력과 열린 의사 소통은 이러한 노력의 필수 요소이다.
Zero Particles가 현실적인 목표인지의 문제가 아니라 환자의 안전을 위해 바람직하고 지속적인 공정 개선을 추진하는 것이다!
Reference
U.S. Pharmacopeial Convention. USP <1790> Visual Inspection of Injections. In USP43–NF38, p. 8587.
Shabushnig, J G. The Changing Visual Inspection Regulatory Environment. Presented at 2021 PDA Visual Inspection Forum, 14-15 April, 2021.
'My Job > Pharmaceutical Quality System' 카테고리의 다른 글
| PDA Annex 1 Workshop: Six Key Takeaways from the Final Annex 1 (0) | 2022.11.19 |
|---|---|
| CAPA ? 재발 방지를 위해 무엇을 할 수 있을까? (0) | 2022.10.31 |
| Change Control Procedure in Pharmaceuticals (변경관리) (0) | 2022.10.31 |
| CAPA 유효성평가 (Effectiveness)에 대한 SMART 접근법 (0) | 2022.10.27 |
| 제약의 Risk management를 위한 10 가지 실용적인 팁 (0) | 2022.10.26 |