새로운 약어 CAPA가 요즘 우리 GMP현장에 자주 등장한다. 이는 FDA inspection에서 등장하는 말로 “Corrective And Preventive Actions” 또는 “Corrective Actions/Preventive Actions”라고 full spelling한다.

최근의 FDA Warning Letters (GMP 준수의 최악의 상황)를 보면 요즘 FDA가 inspection하는 일을 지겨워 하고 있다는 것을 감지할 수 있다. 좀더 구체적으로 얘기하면 FDA는 2년 후 같은 회사를 다시 방문했을 때 다른 부서에서 또는 다른 회사에서 2년 전의 사례와 비슷한 사례가 여전히 반복되고 있다는 것을 발견하게 된다.

예를 들면 QC시험실 inspection에서 밸리데이션되지 않은 spreadsheet를 써서 계산한 것을 발견했다면 2년 후 개발시험실에서 똑 같은 사례를 발견하게 된다. 그렇다. 그 회사는 QC시험실의 그 문제를 틀림없이 해결했다. 그러나 전사적으로 문제를 해결하려는 노력을 전혀 하지 않은 것이다.
FDA 는 최근 어떤 Warning Letter에서 다음과 같이 의미심장한 말을 한 적이 있다. “우리는 귀사의 품질보증 감사를 하는 곳이 아닙니다. 우리는 귀사 내부 조직에서 얼마든지 스스로 찾아서 고칠 수 있는 GMP위반사례를 너무나 많이 발견하게 됨을 심히 유감스럽게 생각하는 바입니다.”
GMP위반사례을 지적하면 회사는 “교육이 부족했다”고 답하고 “작업자를 재교육하겠다”고 개선대책을 내 놓는다. 이것은 설득력이 부족한 핑계고 무성의한 대응이다. 애초의 교육훈련에 무슨 문제가 있었으며 어째서 교육 내용이 충실히 전달되지 않았는지 이런 문제를 영원히 제거하기 위해 어떻게 훈련을 강화할 것인지를 답해줘야 한다.
FDA 는 분명히 말하고 있다:
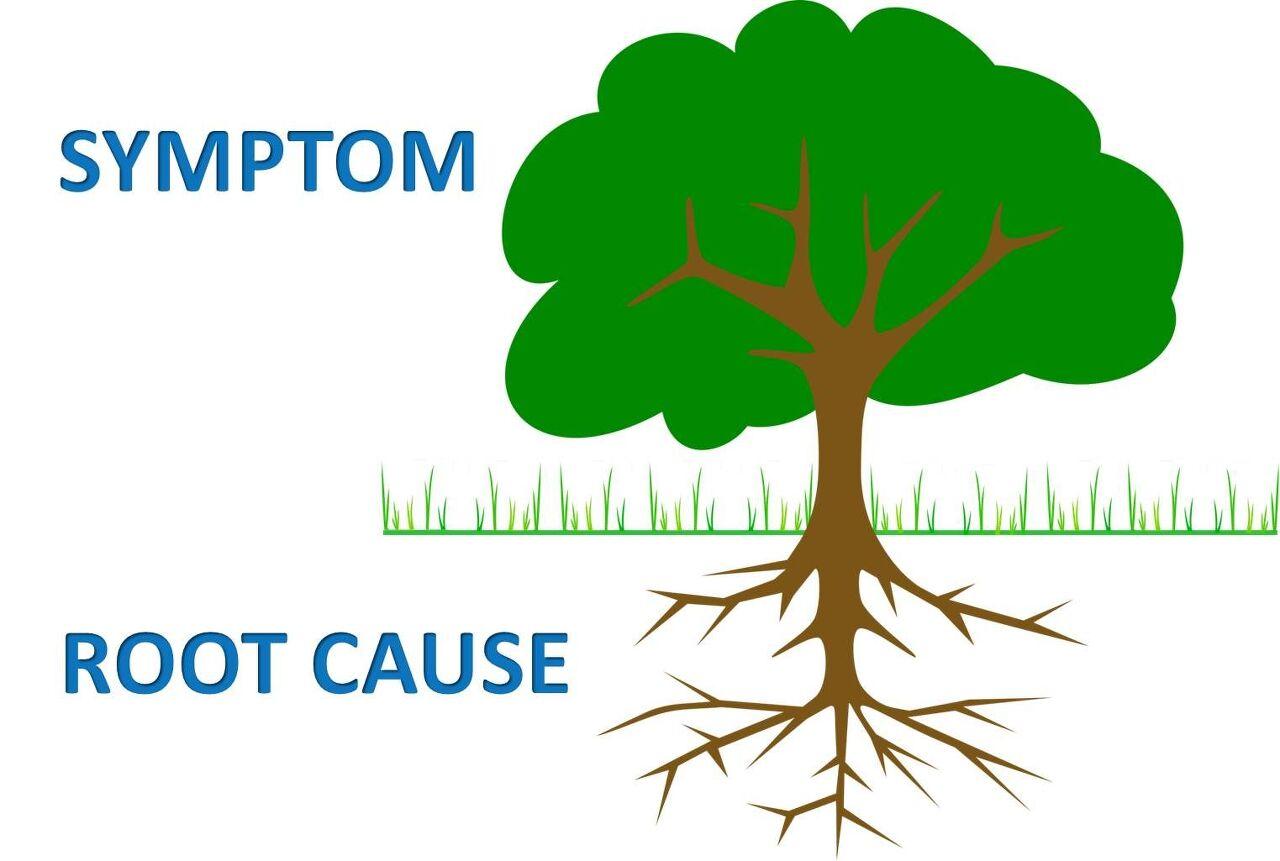
483에 지적한 사항은 그 배경이 되는 근본원인(Root cause)을 철저히 조사하여 항구적이고도 전사적인 시정조치와 예방대책을 강구하여 영구히 해결할 것을 요구한다.
품질에 관하여 충분한 주의를 기울여서 시정조치를 취하는 한 편 그러한 품질문제가 다시 발생하지 않도록 예방대책을 강구할 것 즉 효과적인 CAPA program을 도입할 것을 요구한다.
오늘날 “Root cause” 와 “CAPA”에서 읽을 수 있는 FDA의 생각은 그들은 한 회사의 QA부서로 일하지 않겠다는 것이다.
미국이나 유럽 제약회사 경영층에서 갖고 있는 생각은 “FDA가 지적하면 고치겠다. 만약 지적하지 않으면 문제가 없다”는 것이다. 사실 많은 회사들이 정기적으로 간부회의를 열어 “어느 수준까지 GMP 를 지켜서 FDA로부터 지적을 받지 않을 것인가”에 대해 심각하게 토론한다. 토론은 이런 주제까지 이어진다.
즉 “on-going stability program을 위해서 22명의 직원이 필요하다. 이 프로그램을 중단하면 우리는 연간 백만 달러를 절약할 수 있다. Warning Letter를 받으면 비용이 얼마나 드는가? 만약 FDA가 on-going stability program 의 하자를 발견하고 지적을 하면 잘못을 시인하고 프로그램을 다시 시작하자. 그 동안 우리는 해 마다 엄청난 돈을 절약하는 것이다!” (명예를 고려하여 회사의 실명을 밝히지는 않겠지만 어느 회사에서 이런 토론이 있었는지 나는 알고 있으며 그 간부의 “위험감수와 그 반대급무”에 대한 주장이 분명히 있었으며 아직도 해마다 다음 해의 예산을 짤 때는 이런 논란이 계속되고 있다) 이렇게 했을 때 이 회사는 이듬해에 이익금을 완전히 토해내는 엄청난 벌금을 물게 되어 위험감수와 예산절감의 환상에서 깨어나게 된다. 결국 열악한 품질의 제품을 생산하면 그 대가를 톡톡히 치른다는 것을 깨닫게 될 것이다.
효과적인 CAPA program을 도입하려면 3가지가 필요하다;
제품의 품질에 기여하는 모든 데이터를 효과적으로 수집한다.
사건의 근본 원인을 효과적으로 조사한다.
효과적인 예방조치를 취한다.
효과적으로 데이터를 모은 다는 것은 모든 사건, 사고, 일탈, OOS, OOT, 소비자 불만, 환경의 일탈 기타 제품의 품질에 영향을 미치는 모든 사항을 수집하고 경향을 파악하여 분석하는 것을 말한다. 회사는 회사가 당면하고 있는 품질문제를 파악할 수 있는 모든 정보를 철저히 수집할 수 있는 시스템을 갖추고 정말로 “우리는 제대로 관리하고 있다”고 말할 수 있을까?
'My Job > Pharmaceutical Quality System' 카테고리의 다른 글
| GMP의 역사 및 원칙, 구성 (0) | 2022.11.29 |
|---|---|
| PDA Annex 1 Workshop: Six Key Takeaways from the Final Annex 1 (0) | 2022.11.19 |
| Zero-Particulates 목표는 지속적인 개선을 촉진한다. (0) | 2022.10.31 |
| Change Control Procedure in Pharmaceuticals (변경관리) (0) | 2022.10.31 |
| CAPA 유효성평가 (Effectiveness)에 대한 SMART 접근법 (0) | 2022.10.27 |