멸균 공정에 대한 전반적인 validation 접근 방법 및 예시에 대하여 이어서 이야기 할 것이다.
[Full (Initial) Validation Of Dry Heat Oven & Tunnel]
이번에는 건열멸균기(Dry heat oven) 및 터널멸균기(Tunnel sterilizer)의 validation에 대하여 이야기 해 보겠다.
건열멸균기(Dry heat oven) 및 터널멸균기(Tunnel sterilizer)의 주요 목적인 depyrogenation이다.
depyrogenation이라 함은 미생물이 배출하는 발열성 물질(pyrogen)을 이야기 하며, 이것이 사람에게 주입될 경우 열을 일으키며, 심할 경우 생명에 영향을 줄 수도 있다.
이런 pyrogen은 일반적으로 아래와 같은 공정에서 제거될 수 있다.
Dry heat sterilization cycle –170℃ for not less than 2 hours
Depyrogenation cycle –250℃ for not less than 30 minutes.
건열멸균기(Dry heat oven) 및 터널멸균기(Tunnel sterilizer)의 validation은 오토클레이브와 유사한 접근법을 사용 한다.
Biological indicator – BI는 내열성이 높은 Bacillus Subilisis를 사용하며, 이는 Bacillus Atrophaeus(ATCC #9372)로 분류된다.
Endotoxin indicator - Endotoxin indicator를 사용해야 하며, 일반적으로 최소 1,000개의 Endotoxin 단위(EU)를 접종해야 한다.
먼저 건열멸균기(Dry heat oven)에 대하여 이야기 해 보자.
건열멸균기(Dry heat oven)의 일반적인 원리는 아래 그림과 같이 챔버내부의 순환되는 공기에 Heater가 열을 가하여 공기의 온도를 올리며, 순환된 공기는 HEPA Filter를 거쳐 공급되는 방식이다.
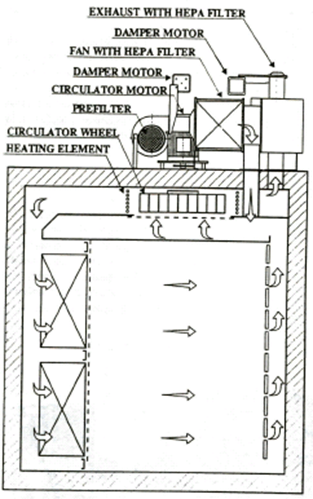
건열멸균기(Dry heat oven)에서 규제기관이 요구하는 허용기준은 아래와 같다.
USP <1211> Sterilization and Sterility Assurance
챔버 내부의 온도가 250℃ 이상에서 대표적인 허용 온도 범위는 ±15℃이다.
10 ~ 12 log의 미생물 생존 확률은 열 안정성이 있는 물품이나 구성품에 대해 달성할 수 있는 것으로 간주된다. (이것은 건조 열 멸균을 위한 것이지, depyrogenation을 위한 것은 아니다)
Endotoxin indicator는 최소 3개의 로그 감소를 나타낸다.
F-value
스팀에는 F0이 사용되지만, dry heat sterilization에서는 기준온도 170℃와 Z값 20℃를 사용하며 이 용어를 Fh값이라고 한다.
D170이 2.5분인 Biological indicator 는 12 log reduction을 달성하려면 최소 Fh 30분이 필요하다. (건식 열 멸균용)
대부분의 건열 Z 값은 17 ~ 23 범위에 있으므로 보통 20분은 허용 가능한 가정으로 간주된다.
Depyrogenation을 위한 F-value
Depyrogenation = endotoxin inactivation
Fh 요건은 10-6보다 훨씬 적은 생물학적 부담의 생존 확률을 보장할 것이다. 그러나, Depyrogenation의 경우, 순환 위험성은 생물학적 부담이 아닌 endotoxin inactivation화에 기초하여 정의되어야 한다.
Fp 값 – 건열멸균기(Dry heat oven)의 경우 기준 온도는 250℃, Z 값은 46.4℃, F 값은 FP라고 한다.
Fh 값과 Fp 값을 혼동하지 마십시오. 범용 Fp 값 제한이 없다.
건열멸균기(Dry heat oven)와 Autoclave의 다른점 및 고려되어야 하는 것은 아래와 같이 이야기 할 수 있다.
열전대 와이어는 고온에서 견딜 수 있도록 절연재를 적용해야 한다. 일반적으로 카프톤 단열재가 선호된다.
HEPA 필터 무결성 – 0.01% 필터 누출 허용
공기 중 입자 – 100등급은 챔버에서 유지되어야 한다.
공기 속도 프로필 – 전체 검증 중에 공기 속도 프로필을 설정해야 한다. 일반적으로 공기 속도는 고른 온도 분포를 위해 평균 단위 속도의 ±25%를 유지해야 한다.
다음은 터널멸균기(tunnel sterilizer)에 대하여 이야기 해 보자.
터널멸균기(tunnel sterilizer)의 원리는 건열멸균기(Dry heat oven)와 크게 다르지 않으며, 단지, Chamber가 아닌, 컨베이어 벨트로 지속적으로 이동하며, 뜨거운 공기를 공급한다는 것이다.
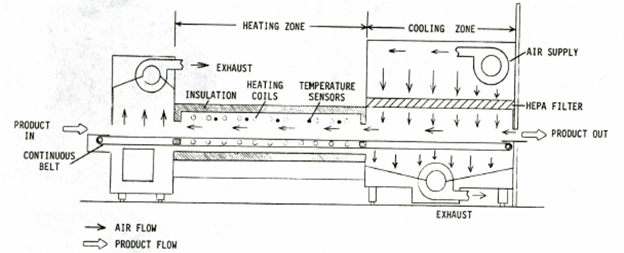
Validation 방법은 크게 다르지 않으나, 컨베이어 이동 속도가 멸균 및 Depyrogenation에 큰 영향을 줄 수 있으므로 이를 고려하여 validation을 설계 하여야 한다.
일반적인 Mapping은 아래와 같다.
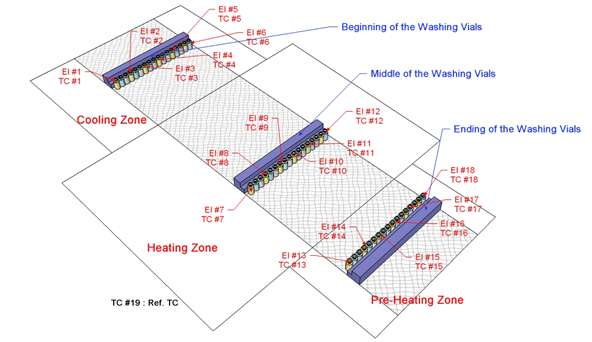
또한 이에 대한 일반적인 허용기준은 아래와 같다.
각 Thermocouple의 Fh 값 ≥? (기록 데이터 기준)
모든 처리된 endotoxin indicator는 endotoxin assay(LAL)를 통해 최소 3 log reduction이 되어야 한다.
주행 시작, 중간 및 종료 시 대략적으로 취한 기준 Thermocouple의 온도는 제어 센서와 5℃ 이하 이어야 한다.
[Conclusions]
드디어 결론이다.
멸균 주기의 검증은 무균성 보장에 매우 중요하다.
D, Z, F 값을 사용하여 멸균 효과를 측정할 수 있다.
보편적인 수용 기준은 없지만 좋은 과학과 좋은 산업 실천이 활용되어야 한다.
정확한 온도 측정은 중요하다. 전체 측정 시스템 체인은 합리적인 측정 불확도를 가져야 한다.
Thermocouple은 validation 전 / 후에 교정을 실시 해야 한다.
Biological indicator or Endotoxin indicators를 각각 검증 목적으로 사용해야 한다.
멸균 주기는 정기적으로(최소한 매년) 검증되어야 한다.
본 글에서 참고된 reference는 아래와 같다.
FDA, 1976, Proposed LVP-GMP
FDA, 2004, Guidance for Industry –Sterile Drug Products produced by aseptic processing
United States Pharmacopia 29
EU GMP, 2003, Annex 1-Manufacture of Sterile Medicinal Products
Canada GMP, 2001, Process Validation: Moist Heat Sterilization for Pharmaceuticals
Singapore GMP, 2004, Guidance Notes on Validation of Terminal Moist Heat Sterilization
EN (European Norm) 285, 1997, Sterilization –Steam Sterilizers –Large Sterilizers
EN 554, 1994, Sterilization of medical devices –Validation and routine control of sterilization by moist heat
HTM (Health Technical Memorandum) 2010, Part 3 Validation and verification of sterilization
PDA Technical Monograph No. 1 “Validation of Steam Sterilization Cycles”, 1978
PDA Technical Monograph No. 1, 2002 Revision (Draft 13), “Industrial Moist Heat Sterilizations in Autoclaves”
PDA Technical Monograph No. 1, 2006 Revision (Draft 18), Validation of Moist Heat Sterilization Processes: Cycle Design, Development, Qualification and Ongoing Control
PDA Technical Report No. 1 Revised 2007, Validation of Moist Heat Sterilization Processes: Cycle Design, Development, Qualification and Ongoing Control
PDA Technical Monograph No. 3 “Validation of Dry Heat Processes Used for Sterilization and Depyrogenation”
Frederick J. Carleton and James P. Agalloco, Validation of Pharmaceutical Processes –Sterile Products, 2ndEdition