FDA Case Studies

FDA Case-Study 1: Substandard Container Closure (규격 미달)
Case-study 1은 정맥주사를 위한 동결건조 제품이다. 해당 제품은 허가 승인 직후 신청자는 결함이 있는 바이알및 제품의 입자 유무를 여러 번 보고하였으며, 결함이 있는 바이알 중 일부는 3rd party에게 보내 결함의 종류와 그 심각도를 평가하였다. 결함은 스토퍼와 교차하는 바이알 입구의 변형, 바이알의 내부 표면에 부착된 유리 입자, 바이알의 neck과 shoulder 부분의 균열 등이 있었다. 조사 결과 CCS(vials and stoppers)는 품질이 불량했으며, 제품의 품질은 제품 무균성의 잠재적 위험과 제품 내 이물질의 존재에 의해 영향을 받을 수 있다고 결론지었으며, 이는 환자 안전에 미치는 영향에는 감염, 염증, 면역반응 및 조직손상이 포함된다. 이에 신청자는 다른 CCS를 선택하기로 결정했다.
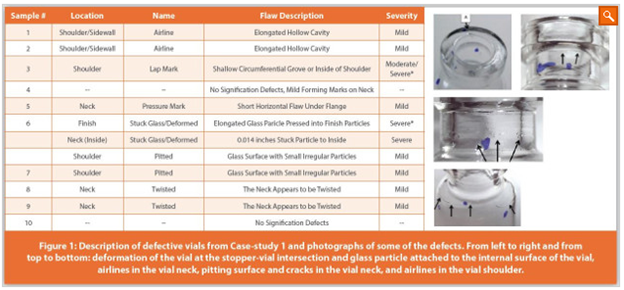
결함이 있는 CCS의 사용은 지난 2년 동안 무균 제품의 자발적인 recall을 가져왔다. 이러한 recall에는 바이알의 rim과 bottom에 균열이 생긴 바이알과 CCI 실패 가능성이 있는 결함 있는 Al-cap 및 제품에 유리 입자가 있는 여러 사례가 포함되었다.
CCIT Not Suitable for Its Intended Use (사용 목적에 적합하지 않은 CCIT)
Case-study 2는 피하주사를 위해 finger flange 와 plunger rod로 조립된 pre-filled syringe(PFS)에 관련한다. 2차 조립 시 CC 조작은 1차 CCS의 무결성에 영향을 미칠 수 있다. 이러한 조작에는 auto injectors에 pre- filled syringes (PFS)의 조립, plunger rod 삽입, needle 안전 장치 등이 포함된다. 조립 작업 중 인라인 제어는 CCS의 무결성에 영향을 미치는 상호작용의 위험을 완화할 수 있지만, 1차 기밀의 무결성은 2차 조립 후에 입증되어야 한다.
case-study 2의 경우, 2차 조립 후 PFS의 integrity를 입증하기 위해 선택된 CCIT 방법은 High Voltage Leak Detection(HVLD) 테스트로, 검체(CCS)을 전류를 발생시키는 2개의 전극 아래에 배치하는 것으로 구성된다. 적합한 샘플은 전기를 전도하지 않는다. 그러나 전기 전도성 제품으로 CCS가 파손되면 샘플의 저항이 감소하여 전극 중 하나에 의해 전기가 감지된다. HVLD 테스트는 테스트 시점에 제품 누출이 발생한 경우에만 위반을 감지할 수 있다. 단, pre-filled syringe의 2 차 조립 중에 발생할 수 있는 needle 또는 needle cover 영역의 손상의 유형은 제품 누출을 초래하지 않기 때문에 HVLD 방법으로 감지 할 수 없다. 무균 CCS가 비 살균 환경에 노출되지 않도록 하기 위해 2차 조립 작업 중에 발생할 수 있는 위험을 감지하기 위해 다른 유형의 CCIT를 구현해야 한다. Case-study 2의 경우, 신청자는 신청 검토 기간 동안 blue dye ingress test를 통해 연구를 반복하기로 동의하였다.
PFS에 포함된 다수의 제품은 잠재적인 무균성 보증 부족으로 인해 자발적으로 recall 되었으며, 이는 제품 syringe와 변조 방지 CC 사이의 상호 작용에 기인 한 것이다. 회수된 PFS는 출하되지 않은 제품의 후속 테스트에서 미세하게 오염된 것으로 나타났다.
Inadequate Execution of the CCIT (CCIT의 부적절한 실행)
Case-study 3은 blue-dye ingress test 방법을 사용하여 CCI에 대해 시험 된 정맥주사를 위한 동결 건조 제품에 관련한다. 상기 방법은 압력 및 진공 사이클 하에서 바이알을 염료 용액에 담그는 방법이며, 시험 종료 시 blue dye가 포함 된 제품이 없어야 한다.
그러나, case-study 3의 경우, 시험 된 바이알은 blue dye ingress을 검사하기 전에 검증되지 않았으므로 관찰자로부터 숨겨진 영역 (예를 들어, 바이알 캡 아래)에 존재하는 blue dye는 검출되지 않았다. blue dye ingress 시험 후 샘플의 재구성은 숨겨진 영역에서 blue dye를 검출 할 수 있게 한다. 검사하는 동안 동결 건조 된 분말을 가진 바이알에서 염료의 검출성이 결여 된 것은 제조회사에 FDA-483이 발행 되었다.
Inadequate CCIT Positive Controls (부적절한 CCIT 포지티브 컨트롤)
분석법 검증은 제품 품질과 안전성에 영향을 줄 수 있는 것을 확인하는 데 적합하도록 하기 위한 것이다. 루틴 CCIT 중에 이러한 관리를 포함하면 method의 올바른 실행을 확인할 수 있다.
FDA는 부적절한 관리를 하거나 CCIT 가 부족한 신청서를 평가했다. 예를 들어, 한 신청서에서 신청인은 Stopper를 통해 삽입 된 26G needle 구멍을 포함한 바이알을 양성 대조군으로서 포함시켰다. 26G 바늘의 내부 직경은 260μm이므로 CCIT가 260μm보다 작은 위반을 감지 할 수 없다. 또한, PFS의 제품에 대한 긍정적인 관리는 부적합한 용기였다. 이 경우에 사용 된 CCIT 방법 (dye ingress test)에는 여러 진공 및 압력 사이클이 포함되어있어 바이알 및 주사기에 다른 영향을 미칠 수 있다. PFS는 압력 차이 동안 plunger의 움직임에 취약하며, PFS에 대한 CCIT 양성 대조군이 적절한 대조군으로 간주되지 않는다.
Case study 4에 설명 된 두 경우 모두, 신청자들은 적절한 양성 대조군을 식별하고 일상적인 시험 중에 이를 사용하기 위해 추가 연구를 수행하기로 합의했다.
Loss of CCI During Vial Crimping (바이알 압착 중 CCI 손실)
Case study 5는 stoppering 후 Al-cap으로 stopper를 단단히 밀봉하고 CCS의 무결성을 유지하는 정맥주사 제품에 관련 한다.
Al-cap을 sealing하는 동안 일반적으로 stopper에 압력을 가하고 Al-cap의 가장자리를 닫고 제자리에 유지하기 위해 Al-cap의 상단과 측면에 힘이 가해진다 (그림 2). 압착 중에 가해진 압력은 바이알에 균열이 생길 수 있고 압력이 충분하지 않으면 바이알이 제대로 밀봉되지 않을 수 있으므로 중요하다. CCI를 유지하도록 설계된 Al-cap sealing의 공정인자는 무균 보증 관점 및 최대 및 최소 후 CCI를 보여주는 정보 및 데이터에서 중요하게 간주된다.
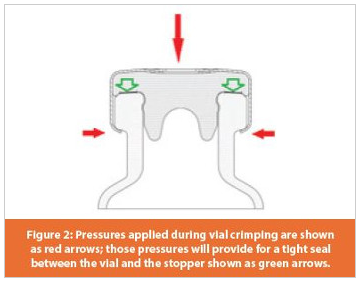
이 경우, 제품은 13mm의 stopper와 4mL 바이알 (4R)과 Flip off cap있는 13mm Al-cap 이었다. 압착 검증에는 3 개의 다른 배치에 대한 CCIT와 배치 당 500 개의 바이알이 포함되었다. 바이알이 부러 지거나 갈라진 것으로 인해 배치 중 하나 (총 3 배치)에서 8 개의 바이알이 부적합(총 11,161 vials)되었다. 다른 하나는 Al-cap seal아래 neck에 균열이 있었다.
이러한 문제에 대하여 광범위한 조사가 시작되었으며, 바이알 압착 공정 동안 바이알에 대한 기계적 스트레스로 인해 균열된 것이 근본 원인으로 확인 되었다. 조사 결과 Al-cap sealing을 위한 헤드는 2mL 바이알에 사용되는 일반 헤드이고 이 바이알은 4R 바이알과 다른 각도를 가지기 때문에 Al-cap sealing 장비가 의도 된 CCS에 적합하지 않은 것으로 나타났다. 또한 3Batch(균열 된 바이알이 있는 배치)은 다른 두 배치에 사용 된 Al-cap seal보다 약간 긴 (0.06-0.09mm) 새로운 Al-cap seal을 사용했다. 이 두 변수 (일반적인 압착 헤드와 긴 밀봉)의 조합으로 인해 바이알에 과도한 압력이 가해져 유리 병 균열이 발생한 것이다.
Corrective action으로, 신청자는 4R 바이알에 맞는 새로운 압착 헤드를 설계했다. 새로운 헤드는 시일 길이의 가변성을 해결하기 위해 일반 헤드보다 작은 직경을 가졌으며 4R 바이알에 적절하였다. 4R 압착 헤드가 설치되었고 압착은 315, 315 및 500 바이알의 3 개 연속 Batch에 대하여 water run으로 검증되었다. 그 결과 샘플이 갈라 지거나 변색 된 것은 발견되지 않았다.
Container Closure Integrity in Bags (Bag의 무결성)
주사제 bag의 integrity test와 관련하여 다른 규제 기관들은 서로 다른 기대를 가지고 있다. EMA는 주사제 bag에 100% CCIT를 필요로 한다. 그러나 FDA는 제조 과정 중 CCI의 견고한 유효성 검사와 일상적인 모니터링 중 CCIT의 범위를 결정하기 위해 신청자가 수행한 위험 평가에 의존한다. bag에 채워진 많은 제품들은 최종 멸균되며, 그 결과, 멸균 공정 중에 발생하는 압력 차이는 100% 육안 검사 중에 부피 손실로 인하여 검출될 수 있다.
Case study 6은 주사제 백의 무균 제품에 관련한다. 밀봉 된 백의 CCI는 공기 주입식 백에 압력(6.0psi)을 가하고 누출(버블)을 육안으로 감지해 공급업체가 검증했다. 방법의 검출한계는 10μm이었다. 단, CCI는 일상 제조 중이나 안정성에 대해 시험하지 않았다.
FDA는 신청서를 검토하는 동안, media fill test 후 하나의 백이 누출되고 운송 검증 연구 동안 다른 하나의 백이 누출되는 것으로 나타났다. Media fill으로부터의 추가 정보는 백의 최대 1.5 %가 채워지지만 "약화 된 1 차 용기 밀봉으로부터의 비일체형 용기의 가능성 또는 1 차 용기 구성 요소의 손상으로 인해 배양되지 않은 것으로 밝혀졌다. 모든 누수 및 잠재적 용기 무균성 결함은 배양되지 않는다.” 신청자는 100 % 육안 검사 중에 누출이 있는 백이 식별 될 것이라고 표시했다. 그러나 육안 검사 중에 미생물 침입을 허용 할 수 있는 작은 누출이 감지되지 않을 수 있음에 따라 무균성 보증이 되지 않는 위험이 발생 할 수 있다.
주사제 백의 누수는 드문 일이 아니다. 예를 들어, 고객 불만으로 인해 최근 5% Dextrose for injection의 recall은 일부 용기가 누출 된 것으로 보였으며, 경우에 따라 눈에 띄는 미립자 물질이 존재하여 미생물 오염으로 확인되었다.

Conclusion
적절한 기밀 유지는 의약품의 품질과 안전 유지에 매우 중요하며, 의약품 개발 단계에서 적절한 CCS와 CCIT를 선택해야 한다. CCIT는 CCS 형식에 적합해야 하며, 적절한 제어 장치 및 통계적으로 유의한 수의 시험 샘플을 포함해야 한다.
의약품 개발 및 유효성 검사 단계에서 추가 연구를 수행하여 제조 작업(최종 멸균, 충전, Bag sealing, Al-cap sealing, 2차 조립) 동안 사용할 변수를 설정하고 해당 변수가 CCI를 손상시키지 않도록 해야 한다. 일상적인 제조 및 안정성 계획에 CCI 테스트를 포함하는 과정에서 멸균 제품 CCS가 통합되고 제품의 유통 기한 동안 멸균 상태가 유지 될 수 있다.
'My Job > Pharmaceutical Quality System' 카테고리의 다른 글
| GMP에서의 CAPA (CAPA MANAGEMENT IN A GMP) (0) | 2022.09.16 |
|---|---|
| 생명과학 기업 확장을 위한 8가지 품질 시스템 요구사항 (0) | 2022.09.05 |
| 주사제 용기 기밀성이 제품 품질에 미치는 영향 (Impact of Container Closure on Drug Safety) (0) | 2022.09.03 |
| 품질관리시스템(QMS) 설계를 위한 위험 기반 접근(Risk-Based Approach) (0) | 2022.09.03 |
| 품질 문화(Quality Culture)가 cGMP 및 QMS에 미치는 영향 (0) | 2022.08.24 |