CAPA 시스템은 특히 제약 산업에서 품질 관리 시스템을 위한 초석이며 품질 개선을 위한 원동력이다. CAPA 시스템은 프로세스, 절차, 조직 및 비즈니스를 체계적이고 잘 문서화되고 실행 가능한 방식으로 개선하기 위한 품질 시스템을 공급한다.
CAPA 시스템이 잘 구축되면 높은 투자 수익률(ROI, Return on Investment)과 아래와 같은 비즈니스 이익이 발생하기 때문에 품질과 운영 우수성 사이에는 강력한 연관성이 있다.
- 안전·보안 개선
- 고객 만족도 향상
- 보다 스마트한 프로세스에서 더 적은 인력이 필요할 수 있으므로 생산성 향상
- 인프라 효율성 향상
- 제품 품질 개선
- 규제 불이행 비용 회피

대부분의 기업들은 품질 시스템이 어떻게 유지되고 감시되는지가 그 효과에 매우 중요하다는 것을 인식해왔다. 위험 기반 CAPA 요건은 불만족, 시스템 고장 또는 프로세스 문제의 근본 원인을 파악하여 문제를 시정하고 재발 방지를 위한 문서화된 시스템을 요구한다. 이 문서는 왜 어떤 것이 잘못되었는지, 혹은 왜 잘못되었을 수 있는지, 그리고 그 일이 다시 일어나지 않도록 하기 위해 어떤 조치를 취했는지 반드시 확인해야 한다.
CAPA 시스템은 문제 및 해결 방법에 대한 문서화된 지표이기 때문에, CAPA 시스템은 일차적인 대상이며, 감사나 규제 검사 때마다 면밀하게 조사된다.
CAPA DEFINITIONS
CAPA에 관한 한, 우리는 3개의 다른 주제를 분리해야 한다:
- Correction or Remedial Action
- Corrective Action (CA)
- Preventive Action (PA)
CORRECTION
위해 또는 바람직하지 않은 불일치 상황을 제거하기 위해 우선 먼저, 수정 또는 시정 조치에 따른 임기응변에 초점을 맞춘다. 그것은 매우 즉각적인 상황에 초점을 맞추는 행동을 일시적으로 그 문제 ‘수정’은 근본 원인을 해결하지 않는다는 데 주목하는 것이 중요하다.
CORRECTIVE ACTION
시정조치(Corrective action)는 이미 발생한 부적합 또는 바람직하지 않은 상황에 대한 대응이다. 불만족상태나 문제가 존재하며 내부 또는 외부 출처에 의해 보고되었다고 가정한다. 개시된 조치는 재발을 방지하기 위한 것으로, 다음과 같은 조치를 포함한다.
- 문제 해결
- 품질체계를 수정하여 원인이 된 공정을 모니터링하여 재발을 방지
- 시정조치의 문서화에서 문제가 발생했다는 증거를 제시
PREVENTIVE ACTION
Prevention Action은 아직 발생하지 않은 부적합 사항이나 바람직하지 않은 상황을 감지하고 발생 전에 이를 예방하기 위한 사전 예방적 접근 및 프로세스다. 이 과정은 다음을 포함한다:
- 잠재적 문제 또는 부적합 사항 파악
- 잠재적 문제/부적합 원인 파악
- 문제 발생을 막기 위한 계획 수립
- 계획 이행
- 취한 조치 및 문제 예방 효과 검토
비즈니스 관점에서 예방 조치는 사후 대응적 접근 방식보다 사전 예방적 접근 방식보다 훨씬 강력하다.
HOW TO IMPLEMENT A CAPA SYSTEM
지속가능하고 강력한 CAPA 시스템을 구현하는 가장 효율적인 방법은 아래에 설명된 것과 같은 closed loop system을 적용하는 것이다(그림 1).
- Identification
- Evaluation
- Investigation
- CAPA Implementation
- Verification
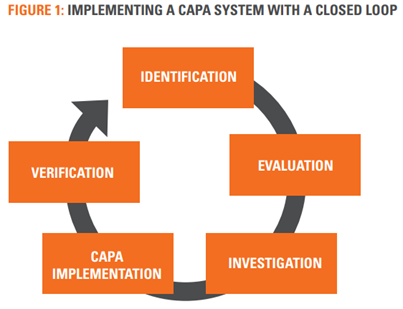
IDENTIFICATION
CAPA가 필요한 비적합성은 다양한 상황에서 발생할 수 있으며 내부 감사, 외부 감사, 규제 검사, 고객 불만 사항, 직원 관찰, 동향 데이터 위험 평가, 프로세스 성능 모니터링, 관리 검토 등을 포함하되 이에 국한되지 않는다.
프로세스의 이 초기 단계에서 문제가 존재한다는 것을 증명할 수 있는 구체적인 정보를 나열하는 것이 중요하다. 이 설명은 간결해야 하지만, 문제가 잘 설명되어 있고 설명을 읽음으로써 쉽게 이해할 수 있다는 것을 보장하기에 충분한 정보를 가지고 있어야 한다. 중점적으로 다뤄야 할 주요 영역은 아래와 같다.
- 정확히 뭐가 잘못됐나?
- 얼마나 자주 발생했는가?
- 문제는 얼마나 큰가?
- 이벤트가 일으키는 영향은?
- 누가 더 많은 정보를 가지고 있는가?
이 단계에서 흔히 볼 수 있는 함정은 예를 들어 이해를 확인하지 못하고, 의견을 사실로 받아들이고, 정보를 철저하고 정확하게 기록하지 못하며, 가장 일반적으로 문제 해결 모드로 너무 빨리 뛰어드는 것이다.
EVALUATION
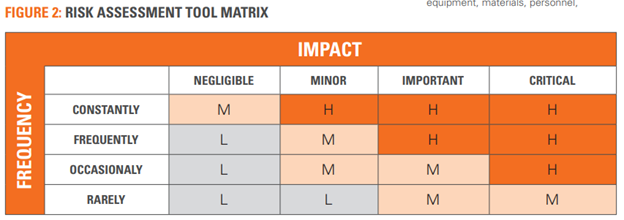
식별 단계가 종료되면, 예를 들어 품질, 안전성, 신뢰성, 비용 또는 고객 만족도와 관련된 잠재적 영향의 관점에서 불만족도를 평가해야 한다. 그림 2의 매트릭스와 같은 위험 평가 도구를 활용하는 것이 권장되고 적합한 도구다.
또한, 조사가 종결되고 시정 조치가 정의 및 시행될 때까지 이 단계에서 교정 조치를 이행해야 할 수 있다.
INVESTIGATIONS AND ROOT CAUSE ANALYSIS (RCA)
그 과정의 첫 두 단계를 통해 더 많은 지식을 얻게 된 지금, 이제 이 문제와 관련된 상황을 검토하여 조사 계획을 준비해야 할 때가 되었다. 표 1에 기술된 특정 기법을 적용함으로써 가능한 모든 원인의 목록을 작성할 수 있다. 이는 문제의 근본 원인을 규명하는 데 필요한 시험 데이터와 같은 관련 정보와 추가 증거를 수집하는 기반이 될 것이다.
모든 가능한 원인(그리고 한가지에만 집중하지 않음), 적절한 관련 정보 및 보완 데이터를 고려하여 부적합의 근본 원인을 결정하는 것이 중요하다.
장비, 재료, 인력, 절차, 설계, 교육, 소프트웨어 및 외부 요인을 고려하고 평가를 위해 수집해야 하는 데이터를 정의하기 위해 가능한 모든 근본 원인을 나열하는 것이 좋다.
Brainstorming sessions, Process Mapping, Value Stream Mapping, Interviews 및 5why 적용이 가장 일반적인 기법이다.
그러나 "우리가 문제를 만들 때 사용한 것과 같은 종류의 사고방식을 사용해서는 문제를 해결할 수 없다"는 사실을 반드시 상기해야 한다(Albert Einstein)
따라서 팀을 포함한 다른 각도에서 문제에 접근하고 다른 또는 새로운 옵션을 탐색하는 것이 효과적인 조사 및 근본 원인 분석의 핵심이다.

CAPA IMPLEMENTATION
조사가 종결되고 잠재적인 근본 원인이 확인된 후, CAPA 실행이 그 다음이다. 계속 진행하기 위해서는 CAPA 계획을 개발해야 하며, 적절한 경우 다음을 포함해야 한다:
- 기타 배치 기록 검토 등 완료해야 할 모든 조치
- 변경 필요서류(예: SOP)
- 프로세스/절차 변경
- 공정 변경에 대해 충분히 상세하게 설명하여 무엇이 필요한지 명확하게 파악해야 한다(일반적인 설명 제외)
- 예상되는 결과를 명확히 하고 을 기술해야 한다.
- 직원 교육
- 문제가 재발하지 않도록 모니터링/제어 실시 CAPA 계획은 각 작업을 완료해야 하는 담당자를 식별해야 하며, 해당되는 경우 시간대와 필요한 추가 자원을 포함해야 한다.
VERIFICATION
이 과정에서 가장 근본적인 단계 중 하나는 CAPA가 마침내 성공적으로 구현되었다는 증거를 제공하는 것이다. 이 평가는 다음과 같은 몇 가지 주요 질문에 대답할 수 있어야 한다:
- 원인을 태클하여 문제가 반복되지 않도록 적절한 조치를 취했는가?
- 정의된 모든 조치 및 변경사항이 완료되고 확인되었는가?
- 적절한 제어 장치가 마련되어 있는가?
- 구현된 솔루션이 제품, 프로세스 또는 서비스에 악영향을 미칠 가능성은?
- 모든 것이 잘 문서화되어 있는가?
SUMMARY
CAPA 시스템은 규제 요건일 뿐만 아니라 생명과학 회사들에게 좋은 사업적 이치를 준다. 기업은 당면한 문제를 해결하기 위한 단기적 조치와 문제의 재발을 막기 위한 장기적 조치를 모두 적절한 시정 조치를 포함하도록 해야 한다. CAPA 시스템을 성공적으로 관리하기 위해서는 기업의 절차를 간소화하고, 시정 및 예방 조치를 걸러내고 우선순위를 정해야 한다. 고위 경영진은 반복적인 문제의 근본 원인을 파악하고 제거하기 위해 적절한 자원을 할당해야 한다.
가장 복잡한 CAPA 문제는 고객 설문 조사와 같은 루틴이 아닌 채널에서 발견될 수 있다. 기업들은 FDA의 경고문을 발송하기 전에 발견하기 어려운 문제점을 발견하여 수정해야 한다.
반복되는 문제의 근본 원인을 제거함으로써 기업은 규제 기대치와 비즈니스 요구 사항을 충족함으로써 많은 이익을 얻을 수 있다.
'My Job > Pharmaceutical Quality System' 카테고리의 다른 글
| 제약 바이오의 품질 문화(Quality culture)에 대하여.. (0) | 2022.09.16 |
|---|---|
| 표면 청정도 모니터링관련 벤치마킹 (0) | 2022.09.16 |
| 생명과학 기업 확장을 위한 8가지 품질 시스템 요구사항 (0) | 2022.09.05 |
| 주사제 용기 기밀성이 제품 품질에 미치는 영향 (Impact of Container Closure on Drug Safety) - 2 (0) | 2022.09.03 |
| 주사제 용기 기밀성이 제품 품질에 미치는 영향 (Impact of Container Closure on Drug Safety) (0) | 2022.09.03 |