통계 분석, 모델링 도구, 기계 학습 및 인공 지능 솔루션의 발전으로 인해 Process validation의 라이프 사이클 단계를 통해 얻은 프로세스 지식의 활용은 바이오/제약 산업에서 기대하는 바가 매우 크다.
U.S. FDA “Guidance for industry: Process Validation: General Principles and Practices에서 이야기 하는 일반 원칙과 세가지 단계:
- Stage 1- Process Design
- Stage 2- Process Qualification
- Stage 3- Continued Process Verification (CPV)

Process validation은 더 이상 단일 유한한 활동이 아니다. Stage 3 진행 중 또는 Continued Process Verification (CPV) 단계는 일상적인 생산 과정에서 프로세스가 검증 된 상태로 유지되고 프로세스가 관리 상태에 있다는 것을 보증하기 위한 공식적인 활동이다. 이 단계는 제약 업계에 다양한 시회와 도전과제를 제시하고 있다.
Stage 3는 stage 3a와 stage 3b 로 가장 잘 분류 될 수 있다. 규제 지침(Regulatory guidance)은 Stage 3a와 Stage 3b를 설명하지 않지만 접근 방식은 업계 관행이다. 특히 공정의 변동성을 이해하고 관리하기 위한 강력한 Stage 3a 평가는 표준화 된 진행중인 Stage 3b 계획의 기초를 제공한다. 효과적인 CPV 프로그램은 예정된 / 정기적 재 검증의 필요성을 줄일 수 있다.
지속적인 프로세스 검증 상태 (State of Continued Process Verification)
Stage 3 (CPV)가 도래함에 따라 얻은 지식을 적용하고 지속적인 개선을 위해 데이터 신호 (데이터의 가변성 또는 예상치 못한 패턴)에 동시에 작용할 것으로 예상된다. 전통적인 연간 제품 품질 검토 (APQR)보다 프로세스 데이터를 더 자주 분석 할 수 있는 이 기회는 CPV 프로그램이 치우침을 식별하고 잠재적인 프로세스 실패를 사전에 제거하는 데 중요하게 역할을 할 것이다.
이상 경향의 빠른 감지는 Process validation에 CPV 단계를 도입 한 이유 중 하나였다. 새로운 프로세스 개발 및 유사한 제품 / 프로세스에도 CPV 통찰력을 적용 할 것으로 예상된다. CPV 단계는 상업용 제조 단계를 나타내므로 CQA (critical quality attribute, 중요 품질 속성), CPP (critical process parameter, 중요 프로세스 매개 변수), KPP (key performance parameter, 핵심 성능 매개 변수) 및 CMA (critical material attribute, 중요 재료 속성)의 더 큰 데이터 세트를 생성 할 것으로 예상된다. 이제 CPV 프로그램에서 효과적인 적용을 위해 새로운 기술, 데이터 분석 및 라이브 데이터 모델링 솔루션을 사용할 수 있다.
Stage 1, 2, 3 데이터에 쉽게 접근 할 수 있는 Process validation lifecycle management system은 지식 관리 및 통찰력 활용에 도움을 주어 지속적인 개선을 지원 한다. 따라서 CPV 데이터를 활용하는 것은 중요한 비즈니스 및 규제 요구 사항이다. QbD(Quality by Design) 접근 방식을 강조하면 QbD(1) 없이 상용화된 기존 제품에 CPV 단계가 매우 중요하다. 이러한 제품에는 Design space를 설정하기 위해 다변량 분석을 위한 공정 데이터가 이미 상당히 많이 있을 수 있다.
PDA 기술 보고서 (PDA Technical Reports)
industry and regulatory technical guidance는 CPV 및 전체 Lifecycle 접근 방식에 대해 계속 발전하고 있다.
PDA Technical Reports는 process validation lifecycle에 대한 통계적 방법 및 접근 방식의 적용에 대한 충분한 통찰력을 제공한다. 예를 들어, PDA Technical Report No. 60: Process Validation: A Lifecycle ApproachPDA 은 2011 FDA process validation guidance에 설명 된 대로 CPV를 사용하는 lifecycle process validation model과 일치하며 lifecycle process validation 주기의 실제 예를 제공한다. PDA Technical Report No. 59 : Utilization of Statistical Methods for Production Monitoring 은 제약 / 바이오 제약 산업에서 신호를 감지하는데 적용 할 수 있는 관련성이 높고 사용하기 쉬운 통계 공정 제어 (SPC, statistical process control) 방법을 제시한다.
차이 (The gap)
PDA 및 규제 기관과 같은 조직은 CPV를 위한 산업 친화적이고 적용 가능한 프로세스를 개발하기 위해 상당한 노력을 기울였다.
표준화 된 샘플링 계획 (예: ASTM)의 적용, SPC 신호 생성 규칙 및 기술 보고서에서 식별된 목적 통계 방법에 대한 적합성 사용이 몇 가지 예 이다. 초기 CPV 프로그램의 개발과 생성된 프로세스 데이터 분석을 지원한다. 그러나 업계가 지속적인 개선 의사 결정으로 성숙함에 따라 CPV 데이터 신호를 관리하기 위해 표준화 된 프로세스를 적용 할 필요가 있다.
현재까지 업계가 이러한 신호에 어떻게 반응해야 하는지에 대한 규제 지침이 없다. 이 격차를 해소하기 위해 PDA Process Validation Interest Group (PVIG)은 " Responses to CPV Data Signal"이라는 하위 주제를 만들었다. 팀의 임무는 CPV 신호 의사 결정 프로세스를 합리화하고 표준화하는 것 이었다. CPV 데이터 신호를 기반으로 내린 결정이 지연되어서는 안되며 높은 수준의 통계 및 과학적 엄격함이 요구되기 때문에 그 필요성이 임박했다. 의사 결정은 사이트 운영 연속성에 영향을 미치므로 연기 할 수 없다. 한 번 내린 일상적인 CPV 결정은 향후 규제 조사를 거쳐야 한다.
또 다른 PVIG 하위 주제 팀은 인공 지능 애플리케이션을 위한 CPV 데이터 의 사용을 탐색하고 있다. 이 이니셔티브는 PQRI와 같은 조직의 지원을 받는다. 미래 Task force의 CPV는 진행중인 생명 공학 프로세스를 제어하는 데 중요한 관련 신호를 식별하는 데 중점을 둔다.
PVIG : CPV 데이터 신호에 대한 응답 (PVIG: Response to CPV Data Signals)
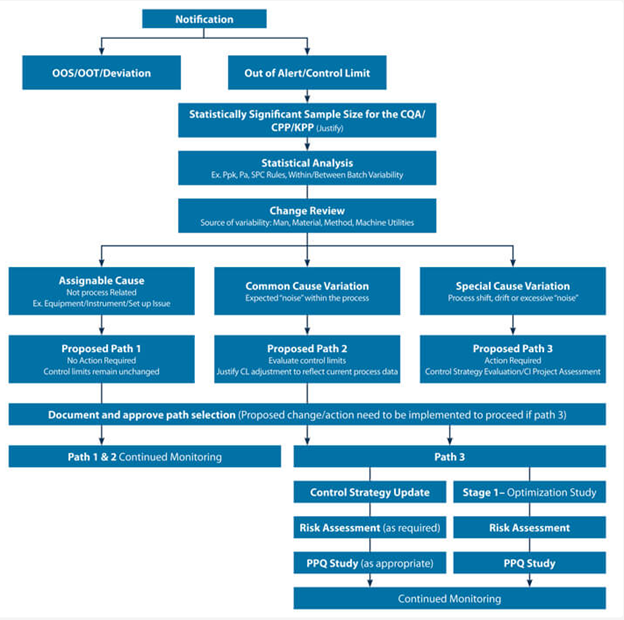
바이오 제약 및 제약 부문의 공정 검증 전문가로 구성된 팀은 브레인 스토밍 세션을 기반으로 의사 결정 트리 모델을 개발했다.
CQA/사양 실패를 나타내는 CPV 신호는 품질 관리 시스템에 의해 다루어지고 표준 운영 절차에 따라 조사됩니다. OOSC(Out-of-Statistical-control) 및 Out-of-Alert/control은 out-of-specification (OOS) and deviation specification limits과 무관한 CPV 제어에 사용되는 제한의 일부이다.
따라서 CPV 신호에 대한 의사 결정 트리 모델을 개발하는 프로젝트의 범위는 CPV 제어 한계를 벗어난 데이터 포인트 신호로 제한된다. 팀은 이러한 유형의 신호를 " yellow flags"로 만들었다. yellow flags는 공정 변동성과 치우침을 나타낸다. FDA process validation guidance은 개별 이벤트에 대한 과잉 반응을 방지하는 방식으로 추세를 수행해야 한다고 명시하는 데 매우 구체적이다. 따라서 신호를 추가로 검토하지 않고 yellow flags를 품질 오류 조사로 자동 분류하는 것은 이상적인 접근 방식이 아니다.
해결 된 문제, 기회 (Problems Solved, Opportunity)
관련 변수 및 신호를 처리하는 방법에 대한 사전 접근 방식은 감지 부족 또는 과잉 반응을 피하는 데 중요하다. 신호는 품질 속성, 재료 속성, 공정 매개 변수 및 / 또는 다양한 심각도의 성능 표시기에 대한 것일 수 있다는 점에 유의해야 한다.
biologics 및 small molecule 제조 공정의 예가 적용 가능성을 검토했다. 의사 결정 트리에서 "Process"라는 용어가 사용되는 모든 경우에는 분석 방법 및 변동성의 원인이 될 수 있는 기타 프로세스가 포함된다. Stage 3a 및 Stage 3b의 묘사가 있는 CPV 프로그램은 초기 상용화 단계 (Stage 3a)에서 생성 된 데이터가 충분하지 않기 때문에 다른 접근 방식이 필요함에 따라 통계적으로 유의미한 표본 크기가 있는 시나리오를 위해 의사 결정 트리가 개발되었다.
제한된 데이터를 사용할 수 있는 경우 추가 데이터가 생성 될 때까지 수행 할 수 있는 작업을 이해하기 위해 사용 가능한 데이터에 대한 심층 분석이 필요하다. 수신 된 신호 (KPP, CPP, CQA 등)의 위험 기반 분류도 필요하다. 이는 모든 신호가 동일하게 생성되지 않아 yellow flags에 대해 다른 조치 계획이 필요하기 때문이다.
제안 된 조치 (가능한 모든 다음 단계 포함)는 신호의 실제 관련성과 통계적 강도를 기반으로 결정되었다. 예를 들어, 관찰 된 치우침이 분리 된 이벤트를 특징으로 하는 프로세스 외부의 할당 가능한 이벤트의 결과 인 경우 Path 1을 사용하는 것이 제안된다. 이 신호는 QMS deviation 또는 event로 식별되거나 식별되지 않았을 수 있다.
Path 2는 현재 공정 데이터를 기반으로 관리 한계 수정이 정당화 될 수 있는 일반적인 원인 변동 인 경우에 제안된다. Path 3은 조사, 근본 원인 결정 및 지속적인 개선 수정 및 / 또는 제어 전략 업데이트가 필요한 특수 원인 변형에 대해 식별된다. 팀의 목표는 제품 / 프로세스 세부 사항을 통합하여 제품에 대해 쉽게 채택하고 사용자 지정할 수 있는 전체적인 의사 결정 트리 예제를 개발하는 것이었다.
피드백 (Encouraging Feedback)
"Responses to CPV Data Signals"에 대한 CPV 하위 그룹의 노력으로 관련 시나리오에 대한 의사 결정 트리 흐름도가 개발되었다. 테스트 케이스는 제안 된 의사 결정 트리의 적용 가능성을 검증했다. 통계적 근거가 있는 구조화 된 의사 결정 프로세스는 주관성 가능성을 최소화하고 규정 준수 위험을 줄인다. 프로세스 흐름을 개발 한 PDA PV 하위 그룹은 관심 있는 PDA 회원과 업계 전문가를 초대하여 프로세스에 도구를 검토하고 적용한다. 이를 통해 얻은 피드백과 통찰력을 통해 팀은 도구를 더욱 세부적으로 조정할 수 있다.
참고 문헌 (References)
U.S. FDA (2009). Q8(R2) Pharmaceutical Development
'My Job > Technical for Pharmaceutical' 카테고리의 다른 글
| 멸균 공정 밸리데이션 (Validation of Sterilization Processes) - 미생물학적 관점 (0) | 2022.09.03 |
|---|---|
| 멸균 공정 밸리데이션 (Validation of Sterilization Processes) - 개요 및 설계시 고려 사항 (0) | 2022.09.03 |
| CCIT (Container Closure Integrity Testing) 컨퍼런스 및 사례 (0) | 2022.09.03 |
| Heat Sterilization (D, Z, F-value) 및 접근 방법 (0) | 2022.09.03 |
| Steam Quality Test (EN 285) 및 Half cycle method for autoclave (0) | 2022.09.03 |