소개 (INTRODUCTION)
Contamination control strategy(CCS)은 의약품 제조의 모든 필수 요소를 고려하는 시스템이다. 이것은 Risk assessment principles과 Contamination control 및 monitoring(detectability of contamination event)을 위한 risk assessment를 사용하여 가장 잘 달성 할 수 있다.
제조되는 의약품의 유형에 따라 효과적인 전략은 다음을 고려한다.
- Microbial contamination (미생물 오염)
- Sterility assurance (무균 보증)
- Facility design (시설설계)
- Chemical contamination (화학적 오염)
- Particle contamination (visible and sub-visible) (입자 오염)
- Viral control (바이러스 통제)
- 혼합, 1차 또는 2차 포장 손상, 유통 문제 및 환경 변동으로 인해 발생할 수 있는 기타 형태의 오염.
모든 Contamination control strategy(CCS)은 제조업체가 위험을 식별하고 해결하도록 유도하기 위해 설계된 주기적인 프로세스이므로 주기적인 검토 및 업데이트가 필요한 것으로 알려져 있다. Contamination control strategy(CCS)은 무균의약품 제조와 관련하여 가장 먼저 논의되지만 대부분의 요소는 비무균의약품 제조에도 적용할 수 있다.
무균 의약품 제조업체는 EU GMP의 Annex 1에서 요구하는 대로 Contamination control strategy(CCS)을 수립해야 한다. 이러한 전략은 FDA Aseptic Filling Guidance과도 일치한다. EU GMP Annex 1(draft, 2020)에 따르면:
“Processes, equipment, facilities and manufacturing activities should be managed in accordance with QRM principles that provide a proactive means of identifying, scientifically evaluating and controlling potential risks to quality.
Risk assessments should be used to justify alternative approaches to those specified in the Annex only if these alternative approaches meet or surpass the intent of this Annex.
A contamination control strategy should be implemented across the facility in order to assess the effectiveness of all the control and monitoring measures employed.
The strategy should consider all aspects of contamination control and its life cycle with ongoing and periodic review and update of the strategy as appropriate.”
이러한 접근 방식은 FDA 지침과도 일치하지만 명시되어 있지는 않다.
Contamination control는 또한 전반적인 Pharmaceutical quality system(PQS)에 의해 지원된다. PQS는 조직이 제조 중인 제품과 관련하여 충분한 전문 지식을 보유하고 결정이 문서화되도록 하는 것을 포함하여 효과적인 품질 시스템에 대한 기대치를 명확히 한다.
강력한 Contamination control strategy(CCS)은 세 가지 구성 요소를 기반으로 한다.
- Manufacturing control strategy: 제품 유형, 수요, 프로세스 및 위험을 기반으로 한다.
- Quality control strategy: 품질 관리 전략: 규제 요구 사항을 충족하는 제조 프로세스에서 중요한 품질 속성의 제어와 함께 위험에 대한 이해를 기반으로 한다.
- Contamination control strategy: 봉쇄/제품 분리에 대한 요구 사항을 포함할 수 있는 교차 오염 통제를 포함한다.
이 글에서는 주요 기능과 구성 요소를 고려하여 Contamination control strategy(CCS)의 구조를 보여주며, 주로 무균의약품 제조와 관련이 있다.
핵심 원칙(CORE PRINCIPLE)
Contamination control strategy(CCS)의 핵심 원칙은 ‘control’이다. control는 다음을 포함하는 일련의 조치를 통해 달성된다.
1. Quality by Design with Quality Risk Management: 여기에는 프로세스 및 위험에 대한 과학 및 지식을 기반으로 적용되는 기술적 제어 조치를 통해 설계에 의한 오염 제어가 포함된다.
2. Organizational Control Measures: Pharmaceutical quality system에 정의된 운영 조직은 인적 요소를 고려하여 절차적 통제(SOP를 통해) 및 관련 위험과 함께 Quality risk management 원칙을 따라야 한다.
오염으로 인한 제품 품질의 위험을 효과적으로 평가하고 제품이 오염될 위험을 사전에 경감하는 통제 조치가 마련되어 있는지 확인하려면 제품과 공정을 충분하고 자세히 이해하는 것이 중요하다.
통제가 확립되면 오염의 사건을 감지할 수 있는 시스템이 마련된다. 여기에는 Environmental monitoring system과 다른 형태의 환경 오염 평가가 포함된다. 그 중심에는 Trend analysis가 있다. EU GMP Annex 1 'Principle' 내에서 기능하는 Contamination control strategy(CCS)은 Control 및 Monitoring 기능에 대한 'Health check' 역할을 한다고 명시되어 있다. 이를 해석할 때 제조 작업 상태에 대한 데이터를 수집하는 것만으로는 충분하지 않다는 점을 인식하는 것이 중요하다. 담당 부서에서 이러한 데이터를 평가하고 통제력 부족의 시작을 나타낼 수 있는 trend를 찾고 더 중요하게는 통제력 불능이 발생하지 않도록 해야 한다.
Control strategy의 주기적인 검토의 일환으로 Trend data의 검토는 Contamination control strategy(CCS)의 Development에 대해 알려야 하며, 해당 문서는 위험 경감에 대한 설명을 포함하여 필요에 따라 조정되는 'Living document'가 된다. Quality metrics과 Deviation의 사유를 평가하면 Contamination control strategy(CCS)의 향후 버전에 대한 평가 및 적용이 필요한 신호가 될 수 있다.
''Living document’의 개념은 아래와 같다.
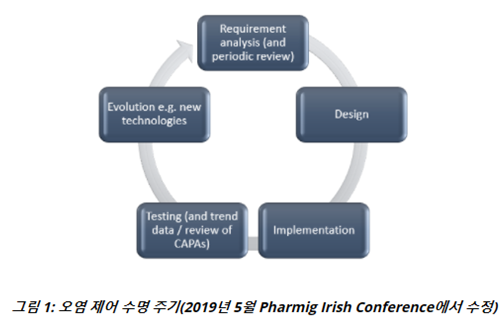
또한, 해당 문서는 계속 진화하는 문서일 뿐만 아니라 Contamination control strategy(CCS)도 사전 예방적 및 사후 대응적 요소를 포함해야 한다. 사전 예방적 측면에는 Contamination control strategy(CCS)를 조직의 품질 문화에 연결하고 사전 위험 평가를 실행하고 지속적인 개선을 포함하는 것이 포함된다. 대응 요소에는 오염 사건에 대한 사전 계획 지침과 오염 문제를 해결하는데 도움이 되는 Corrective and Preventive action system이 포함된다.
통제 조치(CONTROL MEASURES)
Contamination control strategy(CCS)의 기본 요구 사항은 제품 및 프로세스를 충분하고 자세히 이해하여 오염으로 인한 제품 품질의 위험을 효과적으로 평가하고 제품이 오염될 위험을 사전에 경감하는 제어 조치가 있는지 확인하는 것이다.
이는 다음과 같은 일련의 조치를 통해 달성 될 수 있다.
1. 시설 및 장비의 효과적인 Design, Qualification 및 Validation.
2. 제품을 제조하는 동안 프로세스 성능을 모니터링하고 추세를 추적할 수 있는 시스템
3. 문서화된 Risk assessment system을 사용하여 제품 품질에 영향을 미칠 수 있는 프로세스 일탈을 조사할 수 있는 시스템. 일탈에서 얻은 적절한 결과는 Contamination control strategy(CCS)에 Feedback되어야 함. 또한, 발생하는 오염과 관련된 일탈을 조치하고 예방하기 위해 위험 평가 프로세스를 마련해야 한다. 이상적으로는 각 프로세스 단계에 대한 공식적인 위험 평가가 있을 것이다. 즉, 제조 공정 시작부터 무균 처리, 캡핑 및 포장을 모두 포함하고 Good Distribution Practice에 따라 위험 평가는 소비자에게 배송이 되는 지점까지 확장되어야 한다. (여기서 특히 우려되는 사항은 포장 및 용기의 CCIT).
Contamination control strategy(CCS)가 구현되면 정기적으로 유지 관리해야 하며 프로세스의 일부에 대한 변경 사항이 Contamination control strategy(CCS) 및 GMP에 따라 구현되었는지 확인하기 위해 정기적인 Product quality review의 일부가 될 수 있다.
멸균 제조 (STERILE MANUFACTURING)
Contamination control strategy(CCS)는 멸균 제조, 특히 무균의약품의 제조에 특히 중요하다. 무균 충전 제품에 대한 Contamination control strategy(CCS)의 목적은 무균이 보장된 제품의 제조 활동으로 그 이유는 아래와 같다.
- 무균 제조(Aseptic process)에서는 미생물 오염을 방지해야 한다.
- 통계적으로 무균에 대한 보증을 제공할 수 없다.
- 제조업체는 우수한 Contamination control strategy(CCS)에 크게 의존한다.
무균 보증은 제조의 모든 단계(원재료에서 완제품에 이르기까지)에서 제품을 오염으로부터 보호하도록 설계된 GMP 측면을 더 광범위하게 포괄하는 것과 관련하여 전체론적 개념으로 품질보증시스템의 필수적인 부분을 구성한다.