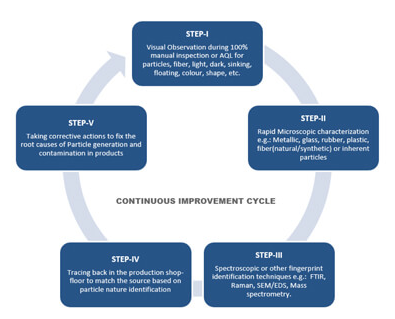
Visual inspection은 제약 제조 공정에서 어려운 단계다. 특히 기포를 완전히 제거할 수 없어 입자와 구별하는 데 문제가 있는 점성이 있는 특성이 까다로운 제품에 대해서는 더욱 그러하다. 그러한 경우 검출과 불 검출의 균형 잡힌 운영 수준을 달성하기 위해서는 Vision algorithms에 대한 긴 개발 및 최적화 시간이 요구된다. 인공지능은 이러한 개발 기간을 단축하고 원하는 결과를 보다 신속하게 최적화할 수 있는 잠재력을 가지고 있다. 즉, 궁극적으로 양질의 제품을 공급하는 제약업체와 이를 공급받는 환자 모두에게 윈-윈(win-win) 상황이다. Inspection 전 제품을 준비할 수 있는 individual spin unit, High resolution digital camera, ..