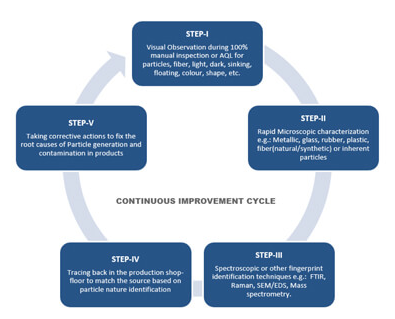
새로운 약어 CAPA가 요즘 우리 GMP현장에 자주 등장한다. 이는 FDA inspection에서 등장하는 말로 “Corrective And Preventive Actions” 또는 “Corrective Actions/Preventive Actions”라고 full spelling한다. 최근의 FDA Warning Letters (GMP 준수의 최악의 상황)를 보면 요즘 FDA가 inspection하는 일을 지겨워 하고 있다는 것을 감지할 수 있다. 좀더 구체적으로 얘기하면 FDA는 2년 후 같은 회사를 다시 방문했을 때 다른 부서에서 또는 다른 회사에서 2년 전의 사례와 비슷한 사례가 여전히 반복되고 있다는 것을 발견하게 된다. 예를 들면 QC시험실 inspection에서 밸리데이션되지 않은 spr..